Vplyv mentálnej anorexie na kostný metabolizmus
Effect of anorexia nervosa on bone metabolism
Anorexia nervosa is the third most common chronic illness in adolescent girls. Clinical symptoms develop most frequently during sexual maturity. It is a period, when deprivation of nutrients with hormonal dysregulation can disrupt bone formation with microarchitectonic and structural changes and decrease bone mineral density. Objective: The aim of this study was to evaluate bone metabolism and hormonal changes in girls with anorexia nervosa. Patients and methods: There were 65 girls with anorexia nervosa between 10–18 years of age enrolled in this study. We divided the patients into 2 groups: Z-score BMI > -2 SD (A), Z-score BMI ≤ -2 SD (B). We evaluated disease and amenorrhea duration, body mass index, hormonal profile and bone metabolism parameters. We examined the bone mineral density using dual X-ray absorptiometry. The results were evaluated using mathematical – statistical methods. Results: In the lower weight group (B) were significantly lower serum concentration of phosphorus, gonadotropins (LH, FSH), estradiol and IGF-1 and higher serum cortisol concentration, as well as significantly higher calciuria. Bone formation markers (PINP 1) as well as bone turnover marker – osteocalcin were significantly lower in girls with Z-score BMI ≤ -2 SD, while bone resorption marker – CTx did not differ between groups. Bone mineral density was decreased in 14 (21.5 %) of anorectic girls. Predictor of low spinal bone mineral density was duration of secondary amenorrhea. Conclusion: Nutritional deficiency in anorexia nervosa alters neuroendocrine pathways that negatively affect bone tissue and suggest a unique osteopathic condition in anorexia nervosa patients.
Keywords:
anorexia nervosa – bone metabolism – bone mineral density – children – Hormones
Autoři:
Čagalová Alžbeta 1; Tichá Ubica 1; Killinger Zdenko 2; Podracká Udmila 1
Působiště autorů:
Detská klinika LF UK a Národný ústav detských chorôb, Bratislava
1; V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava
2
Vyšlo v časopise:
Clinical Osteology 2020; 25(1): 37-43
Kategorie:
Přehledové články
Souhrn
Mentálna anorexia je tretie najčastejšie chronické ochorenie u adolescentných dievčat. Klinické symptómy sa rozvíjajú v období puberty, keď nutričná deprivácia s následnou hormonálnou dysreguláciou môžu narušiť modeláciu kostí s mikroarchitektonickými a štrukturálnymi zmenami a znížením denzity kostného minerálu. Cieľ štúdie: Hodnotiť kostný metabolizmus a hormonálne zmeny u pacientok s mentálnou anorexiou. Pacienti a metódy: 65 dievčat s mentálnou anorexiou vo veku 10–18 rokov sme rozdelili do 2 skupín: Z-skóre BMI > -2 SD (A) a Z-skóre BMI ≤ -2 SD (B); BMI = body mass index/index telesnej hmotnosti, SD – Standard Deviation/smerodajná odchýlka. V každej skupine sme hodnotili trvanie ochorenia a amenorey, indexy telesnej hmotnosti, hormonálny profil a parametre kostného metabolizmu. Pomocou duálnej röntgenovej absorpciometrie sme vyšetrili denzitu kostného minerálu. Výsledky sme spracovali pomocou matematicko-štatistických metód. Výsledky: V skupine s nižšou hmotnosťou (B) boli signifikantne nižšie sérové koncentrácie fosforu, gonadotropínov (LH, FSH), estradiolu a IGF1 a vyššia sérová koncentrácia kortizolu, ako aj signifikantne vyššia kalciúria. Marker kostnej formácie (PINP1), ako aj marker kostného obratu – osteokalcín boli signifikantne nižšie u chudších dievčat, kým marker kostnej resorpcie – CTx sa medzi skupinami nelíšil. Denzita kostného minerálu ≤ -2 SD bola u 14 (21,5 %) anorektičiek. Prediktorom nízkej denzity v oblasti lumbálnej chrbtice bolo trvanie sekundárnej amenorey. Záver: Nutričná karencia pri mentálnej anorexii alteruje neuroendokrinné mechanizmy, ktoré negatívne vplývajú na kostné tkanivo a poukazujú na jedinečný osteopatický stav pri mentálnej anorexii u adolescentiek.
Klíčová slova:
denzita kostného minerálu – deti – hormóny – kostný metabolizmus – mentálna anorexia
Úvod
![Diagnostické kritériá pre mentálnu anorexiu [3]](https://www.clinicalosteology.org/media/cache/resolve/media_object_image_small/media/image_pdf/a44a9144038295da75f79c71a43e69ab.png)
Dlhodobá nutričná karencia vedie k celkovej alterácii organizmu a je spojená so závažnými zdravotnými komplikáciami. Dôsledkom adaptívnej reakcie organizmu na nízky energetický prísun sú dysregulačné zmeny v neuroendokrinných dráhach. Hypogonadotropný hypogonadizmus, relatívna hyperkortizolémia, rezistencia na rastový hormón (GH – growth hormone), nízke koncentrácie inzulínu podobného rastového faktora 1 (IGF1 – insulin like growth factor 1), či poruchy tyreotropnej osi sú prítomné takmer u všetkých anorektických pacientov. Drvivá väčšina adaptívnych neurohormonálnych zmien negatívne ovplyvňuje formáciu kosti a zvyšuje osteoresorpciu, čo má za následok neprimerane nízku denzitu kostného minerálu a poruchu mikroarchitektúry kostí.
Dospievanie je kritické obdobie pre vývoj a metabolizmus skeletu. V adolescencii dochádza k mohutnej tvorbe kostnej hmoty a narušenie osteoformačných procesov v prudko rastúcom skelete spôsobí, že sa optimálne maximum nedosiahne. Znížená denzita kostného minerálu je veľmi častou komplikáciou mentálnej anorexie a môže pretrvávať dokonca aj po zlepšení stravovacích návykov a adekvátnom hmotnostnom prírastku [4]. Podľa prierezových denzitometrických štúdií až polovica adolescentiek s MA má Z-skóre denzity kostného minerálu (BMD – bone mineral density) v oblasti lumbálnej chrbtice menej ako -1 SD a až 21 % z nich má nízku denzitu (Z-skóre BMD ≤ -2 SD) [5].
Cieľom našej prierezovej štúdie bolo analyzovať auxologické a hormonálne parametre a laboratórne ukazovatele kostného metabolizmu vo veľkej kohorte dievčat s mentálnou anorexiou a zhodnotiť ich vzťah k denzite kostného minerálu.
Pacienti a metódy
Súbor tvorí 65 dievčat s mentálnou anorexiou, ktoré boli hospitalizované na Detskej klinike LF UK a NÚDCH v Bratislave v rokoch 2015–2019. Diagnózu sme stanovili podľa Diagnostického a štatistického manuálu duševných porúch, 5. vydanie [3]. Všetky pacientky boli v akútnom štádiu ochorenia. Pacientky s chronickým ochorením alebo liečbou, ktorá by mohla ovplyvniť laboratórne výsledky a kostný metabolizmus, sme zo štúdie vylúčili.
Anamnestické a klinické údaje sme získali pri prijatí na kliniku, v čase stanovenia diagnózy. U každej probandky sme vyhodnotili vek a aktuálnu telesnú hmotnosť pri diagnostikovaní ochorenia, dĺžku trvania ochorenia pred hospitalizáciou, nástup menarché a trvanie amenorey. Za vznik ochorenia sme považovali obdobie, keď pacientka v čase najvyššej dosiahnutej telesnej hmotnosti začala cielene chudnúť.
U každej pacientky sme vypočítali hmotnostný úbytok (kg) a deficit hmotnosti (%) oproti ideálnej hmotnosti vzhľadom k výške, a Z-skóre BMI pre daný vek a pohlavie (SD) [6]. Podľa hodnôt Z-skóre BMI sme rozdelili pacientky do 2 skupín: skupina A: BMI SD > -2 SD, n = 32; skupina B: BMI SD ≤ -2 SD, n = 33 dievčat.
Vzorky krvi sa odoberali nalačno medzi 6. a 7. hodinou ráno. V jarných a letných mesiacoch roka sa odobralo 57 % vzoriek, 43 % vzoriek v jesennom a zimnom období. V sére sme vyšetrili koncentrácie vápnika, fosforu a alkalickej fosfatázy rutinnými laboratórnymi metódami. Z hormonálneho profilu sme chemiluminiscenčnými metódami vyšetrili estradiol, luteinizačný hormón (LH), folikuly stimulujúci hormón (FSH), kortizol, 25-OH vitamín D, intaktný parathormón (iPTH), rastový hormón (GH) a inzulínu podobný rastový faktor (IGF1). Osteokalcín, aminoterminálny propeptid prokolagénu typ 1 (P1PN) a C-terminálny telopeptid kolagénu (CTx) v sére sa analyzovali imunochemicky. Urinárny index kalcium/kreatinín sme vypočítali z pomeru koncentrácie kalcia a kreatinínu v jednorázovej vzorke raného moču, kalciúriu sme vyšetrovali z 24-hodinového zbieraného moču.
Meranie denzity kostného minerálu
Denzitometrické vyšetrenie kostí sa realizovalo metódou duálnej röntgenovej absorpciometrie (DXA – dual X-ray absorptiomety) na prístroji Hologic, Inc. Horizon QDR. Denzita kostného minerálu sa hodnotila v oblasti lumbálnej chrbtice (L1-L4), celého tela a celého tela bez zachytenia lebky (TBLH – total body less head). Vo výsledkoch sme hodnotili denzitu kostného minerálu (BMD – bone mineral density). Výsledky BMD sme porovnali s referenčnými hodnotami a vyjadrili ako Z-skóre (SD) pre pohlavie a vek. Za zníženú plošnú denzitu kostného minerálu u detí a adolescentov sa podľa konsenzu Medzinárodnej spoločnosti klinickej denzitometrie (International Society of Clinical Densitometry) z roku 2007 považuje Z-skóre BMD ≤ -2 SD [7]. Pomocou celotelovej denzitometrie sme stanovili telesnú kompozíciu – percento telesného tuku (%), hmotu tuku (fat mass, kg) a svalovú hmotu (lean mass, kg).
Štatistické spracovanie
Získané údaje sme spracovali použitím štatistického softvéru IBM Statistical Package for the Social Sciences (SPSS), verzia 23. Normálna distribúcia dát sa overila Shapirovom-Wilkokovým testom. Klinické a biochemické dáta, hormonálny profil, denzita kostného minerálu a zloženie tela sa analyzovali Studentovým t-testom pre parametre s normálnou distribúciou, resp. Mannovým-Whitneyovým U-testom, ak údaje nemali normálnu distribúciu. Závislosti medzi nameranými parametrami sme počítali Pearsonovou lineárnou koreláciou alebo Spearmanovým koeficientom korelácie, ak dáta nemali normálnu distribúciu. Výsledky sú prezentované ako priemerná hodnota ± smerodajná odchýlka. Za štatisticky významnú sme považovali hladinu p < 0,05.
Výsledky
Auxologické parametre
Priemerný vek probandiek v čase stanovenia diagnózy bol 14,7 ± 0,3 rokov (rozmedzie 10,2–18,7 rokov). Klinické symptómy anorexie sa manifestovali v priemere 12,9 ± 1,3 mesiacov (rozmedzie 3–48,5 mesiacov) pred hospitalizáciou. Amenorea (vynechanie > 3 menštruačných cyklov po sebe) bola prítomná u všetkých 65 dievčat (primárna amenorea n = 21, z čoho v predpubertálnom štádiu bolo 8 dievčat, sekundárna amenorea n = 44).
Porovnanie veku, trvania ochorenia, amenorey a auxologických parametrov v skupine A a B uvádza tab. 2. Pacientky s väčším hmotnostným úbytkom (Z-skóre BMI ≤ -2 SD – skupina B, n = 33) boli staršie, ako pacientky v skupine A (p < 0,05). Skupiny sa nelíšili dĺžkou trvania ochorenia a amenorey, ani telesnou výškou probandiek (p = ns).
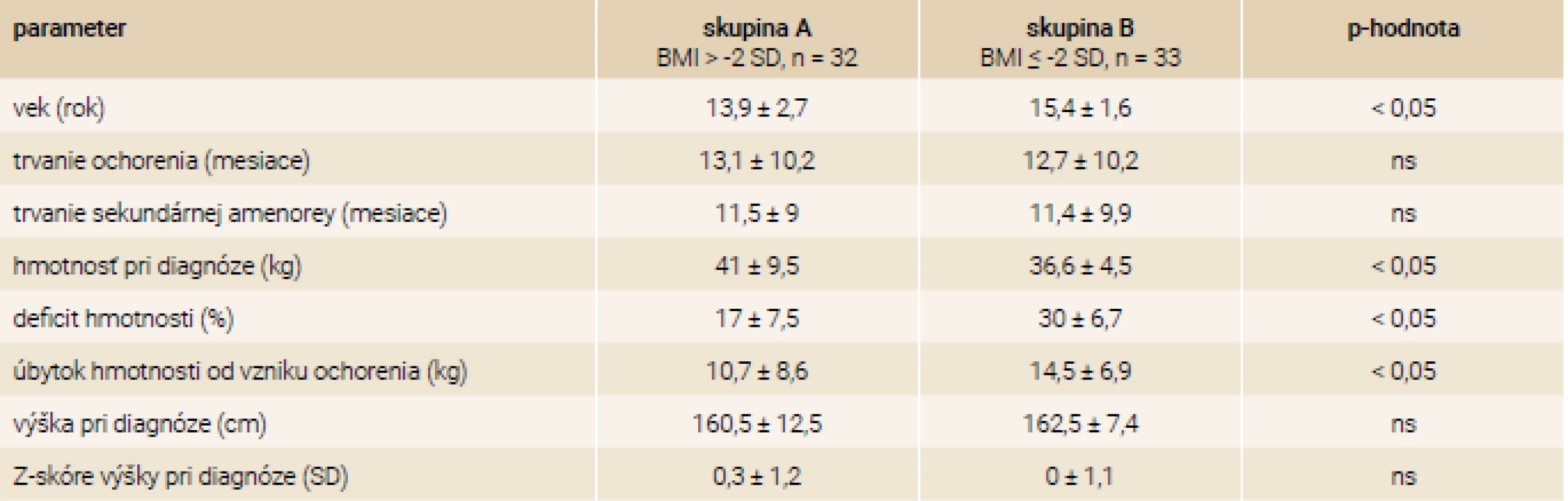
Biochemické parametre
Dievčatá v skupine B mali signifikantne nižšie koncentrácie fosforu a alkalickej fosfatázy a signifikantne vyššiu kalciúriu ako dievčatá v skupine A (p < 0,05), tab. 3. Priemerné koncentrácie 25-OH vitamínu D sa v oboch skupinách významne nelíšili (p = 0,4).
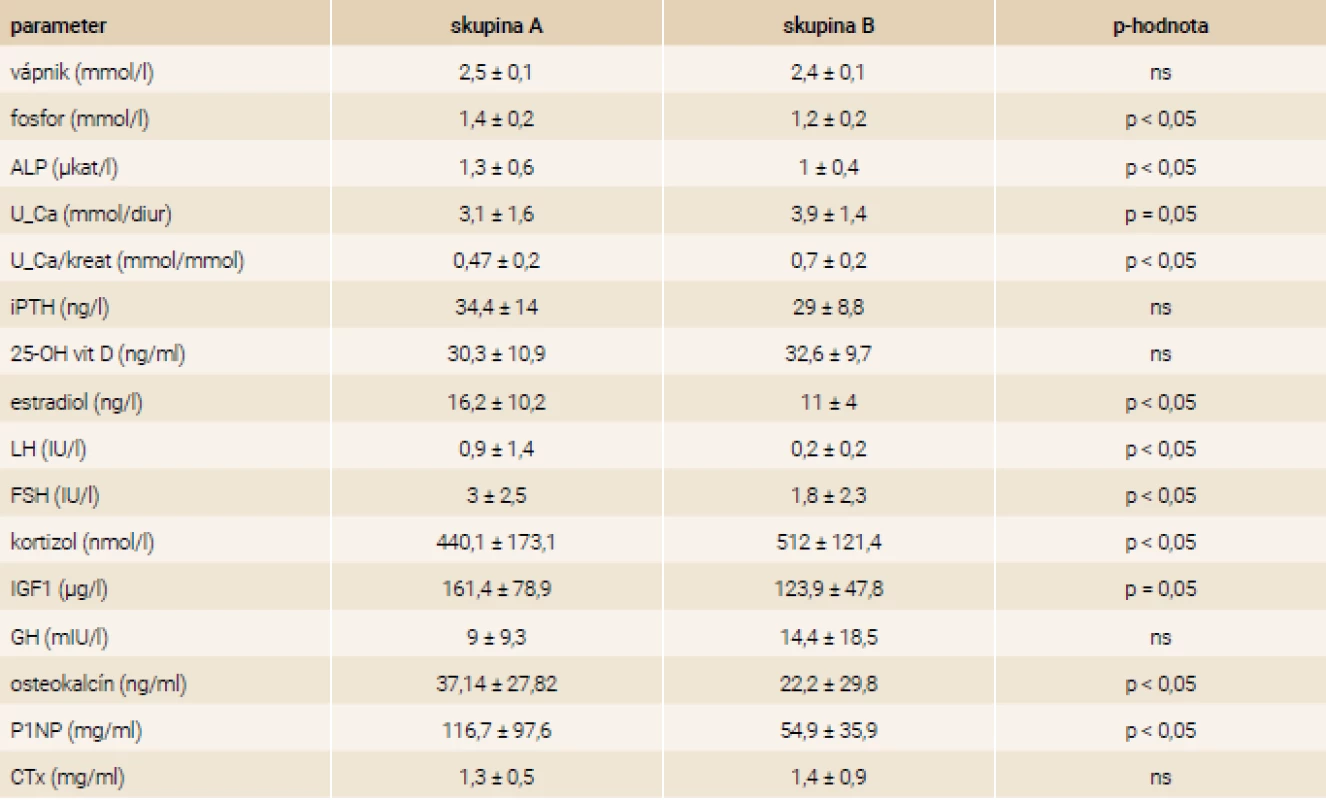
Hormonálny profil
Hoci dievčatá v skupine B boli staršie, mali signifikantne nižšie koncentrácie LH, FSH a estradiolu ako mladšie dievčatá v skupine A (p < 0,05), tab. 3. Pacientky s nižším BMI mali signifikantne vyššiu kortizolémiu (p < 0,05), nižšie hodnoty IGF1 (p = 0,05), ale rozdiel v GH medzi skupinami nebol signifikantný (p = 0,4). Priemerné hodnoty iPTH sa v skupinách významne nelíšili (p = 0,12).
Špecifické markery kostného metabolizmu
Dievčatá s BMI SD ≤ -2 SD mali signifikantne nižší osteokalcín a P1NP v porovnaní s mladšími dievčatami s BMI SD > -2 SD (p > 0,05). Hodnoty CTx sa medzi analyzovanými skupinami nelíšili (p = 0,88) (tab. 3).
Telesná kompozícia a denzita kostného minerálu
Dievčatá v skupine B mali signifikantne nižšiu tukovú hmotu a percento tuku (p < 0,05), tab. 4, a vyšší úbytok hmotnosti od vzniku ochorenia (tab. 2) ako aj signifikantne nižšie Z-skóre BMD v oblasti lumbálnej chrbtice (p < 0,05), tab. 4. Z-skóre BMD v celotelovom meraní a BMD TBLH boli v oboch skupinách porovnateľné (p = 0,2 a p = 0,8). Napriek tomu v celej kohorte pacientok malo až 44,6 % (n=29) Z-skóre BMD ≤ -1 SD aspoň v jednej z meraných oblastí, z nich dokonca 14 probandiek (21,5 %) malo nízku denzitu (Z-skóre BMD ≤ -2 SD). V lumbálnej oblasti malo Z-skóre BMD ≤ -2 SD 10 dievčat (15,4 %).
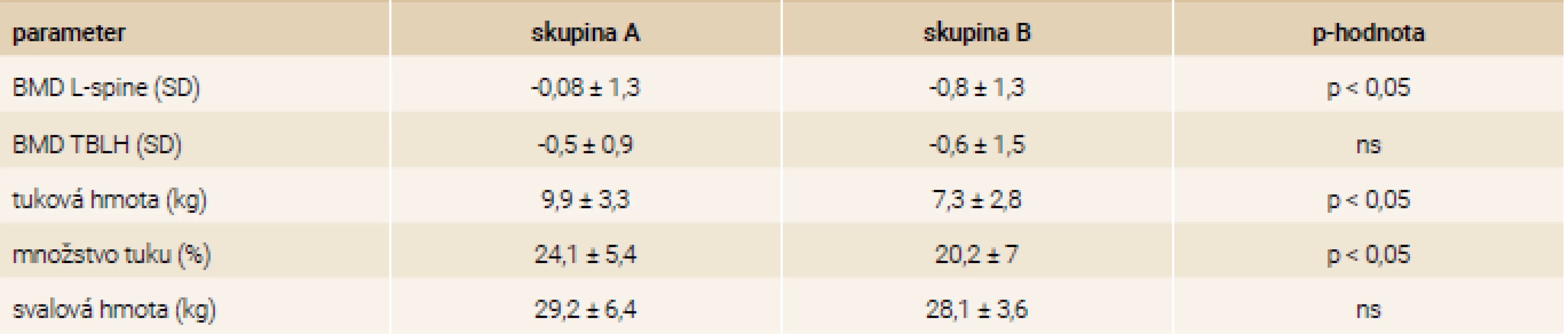
Korelačná analýza
Korelačnou analýzou sme zistili pozitívnu asociáciu medzi trvaním amenorey a dĺžkou ochorenia (ρ = 0,440; p < 0,05). IGF1 negatívne koreloval s CTx (ρ = -0,381; p < 0,05) a kortizol negatívne koreloval s osteokalcínom (ρ = -0,270; p < 0,05).
Z-skóre BMD v oblasti lumbálnej chrbtice negatívne korelovalo s trvaním sekundárnej amenorey (ρ = -0,356; p < 0,05), pozitívne so Z-skóre BMI SD (r = 0,383, p < 0,05) a 25-OH vitamínom D (r = 0,325, p < 0,05), graf. Z-skóre BMD TBLH pozitívne asociovalo s IGF1 (ρ = 0,364; p < 0,05).

Diskusia
Hlavným symptómom mentálnej anorexie je cielené znižovanie telesnej hmotnosti systematickým aktívnym odmietaním príjmu potravy. Až 50 % probandiek z analyzovaného súboru malo pri diagnostikovaní ochorenia Z-skóre BMI ≤ -2 SD, čo zodpovedá ťažkému nedostatku telesnej hmotnosti – kachexii. Obmedzovanie stravy, malnutrícia a dlhotrvajúca karencia stavebných živín nevyhnutných pre adekvátnu tvorbu a optimálnu štruktúru kostí, ako sú vápnik, fosfor, horčík a vitamín D, majú za následok poruchu fyziologického vývoja dieťaťa. Závažná nutričná karencia a výrazný deficit telesnej hmotnosti vyvolávajú početné sekundárne neuroendokrinné zmeny.
Pacientky s nižším BMI a nižším objemom tukovej hmoty mali nižšie sérové koncentrácie gonadotropínov a estradiolu. V dôsledku podvýživy sa znižuje pulzná sekrécia gonadotropín uvoľňujúceho hormónu v hypotalame a klesá vylučovanie LH a FSH. Anorektičky majú sekrečnú krivku gonadotropínov ako v predpubertálnom období alebo v období včasnej puberty. Nedostatočná stimulácia LH bráni adekvátnemu vzostupu gonadálnych hormónov a vedie k hypotalamickej hypogonadálnej amenorei [1]. V súlade so závermi prierezovej štúdie autorov Misra et al sme preukázali, že trvanie sekundárnej amenorey s hypogonadizmom markantne zhoršujú kostný metabolizmus a môžu predikovať nízku denzitu kostného minerálu pri anorexii [8]. Estrogény majú dôležitú úlohu v homeostáze skeletu, najmä pre svoj anabolický efekt na kosť. Inhibujú uvoľňovanie proinflamatórnych cytokínov a zvýšením osteoprotegerínu tlmia aktivitu RANKL (ligand receptorového aktivátora pre nukleárny faktor κ-B), čím sa znižuje osteoklastami sprostredkovaná kostná resorpcia. Z klinických pozorovaní vyplynulo, že deficit estrogénov má negatívny účinok najmä na trabekulárnu kosť a zodpovedá za 3–5% úbytok kostnej hmoty za rok [9]. Je zaujímavé, že u žien s MA sa kosť „správa“ inak ako pri ostatných stavoch s deficitom estrogénov, keď je selektívne porušená iba osteoresorpcia. To potvrdzuje aj signifikantne nižšia koncentrácia estradiolu v skupine našich pacientok s nižšou hmotnosťou. Koncentrácia osteoresorpčného markeru (CTx) sa v skupinách nelíšila.
Dôležitým hormonálnym determinantom nízkej kostnej denzity pri MA je deficit IGF1. Sérové koncentrácie IGF1 sú priamym ukazovateľom nutričného statusu jedinca. Aj v našej kohorte koncentrácie IGF1 úmerne klesali s deficitom BMI a telesného tuku napriek tomu, že sekrécia IGF1 v období adolescencie vrcholí a klesajúci trend nadobúda až v dospelosti. IGF1 podporuje lineárny rast kosti najmä ovplyvňovaním diferenciácie a proliferácie chondrocytov na rastovej platničke, ako aj tvorbu periosteálnej formácie a rast kortikálnej kosti [10]. Markantný deficit IGF1 a porucha výživy determinujú nízku formáciu kostí [11], čo potvrdzujú aj naše denzitometrické dáta a nález nižšej denzity kostného minerálu asociovanej s nízkym IGF1. Na nízky kostný obrat a poruchu dynamickej rovnováhy v kostnom obrate v našom súbore poukazujú aj signifikatne nižšie markery kostnej formácie (ALP, P1NP) a kostného obratu (osteokalcín) v skupine dievčat s väčšou stratou hmotnosti. Subklinické kostné straty tak vznikajú už v pubertálnom období so zníženou akumuláciou kostného minerálu [5]. Ukazovateľ osteoresorpcie (CTx) sa v jednotlivých skupinách nelíšil, na rozdiel od iných štúdií [12,13]. Tieto nálezy sú v kontraste s fyziologickými procesmi remodelácie kostí u zdravých adolescentných rovesníkov [13].
Relatívny nadbytok sekrécie kortizolu u našich pacientok je konštantným sprievodným nálezom pri MA. Hlavnými prediktormi kortizolémie je nutričný stav, glykémia a inzulín [14]. Hypoglykémia a hypoinzulinémia pri MA stimuluje vylučovanie kortizolu na udržanie euglykémie prostredníctvom glukoneogenézy. Hyperkortizolémia prispieva k zníženiu denzity kostného minerálu viacerými mechanizmami. Kortizol stimuluje osteoklastami sprostredkovanú kostnú resorpciu, inhibuje proliferáciu, diferenciáciu a aktivitu osteoblastov a podporuje apotózu osteocytov. V súlade s inými autormi sme zistili inverznú závislosť medzi koncentráciou kortizolu a markerom kostného obratu (osteokalcín) [14]. Inými slovami, čím bol vyšší kortizol, tým bola nižšia osteoformácia.
Nízka denzita kostného minerálu u našich chorých korešpondovala aj s hypovitaminózou D. Hoci primerané hodnoty vitamínu D sa v skupinách nelíšili, až 43 % pacientok z celej kohorty malo insuficienciu 25-OH vitamínu D (25-OH vitamín D < 30 ng/ml) a 14 % dievčat stredný deficit vitamínu D (25-OH vitamín D < 20 mg/ml) [15].
Hypovitaminóza D spolu s hyperkotizolémiou prispieva k negatívnej kalciovej bilancii a spoločne znižujú absorpciu vápnika črevom. Okrem toho kortizol zvyšuje jeho exkréciu močom [16]. Anorektičky s nižšou hmotnosťou mali signifikantne vyššiu kalciúriu ako dievčatá s relatívne vyššou telesnou hmotnosťou, dôkazom čoho je aj vyššia kortizolémia v tejto skupine pacientok. Podobne aj Audí et al uvádza v prierezovej štúdii u 73 adolescentných anorektičiek s aktívnym ochorením (BMI < -1 SD, amenorea > 3 mesiace) signifikantne vyššiu kalciúriu a kalcium/kreatinínový index v porovnaní s pacientkami s hmotnosťou > -1 SD a pravidelným menštruačným cyklom [17].
Oblasť lumbálnej chrbtice je najvhodnejším miestom na monitorovanie skeletálnych zmien pri MA [18]. Trabekulárna kosť v lumbálnej oblasti je metabolicky aktívnejšia a citlivejšie reaguje na zmeny ako kortikálna kosť [19]. Signifikantne nižšia denzita kostného minerálu u našich nutrične horších dievčat potvrdzuje predominantné postihnutie trabekulárnej kosti pri nutričnom deficite. Za dôležité zistenie považujeme nález nižšej kostnej denzity u takmer štvrtiny dievčat, čo korešponduje s publikovanými údajmi iných autorov [5,20].
Relevantné hodnotenie osteomarkerov, ako aj hormónov je náročné, keďže ich sérové koncentrácie sa menia v priebehu puberty [21]. Pre ich vyššiu validitu je potrebné posudzovať markery so zreteľom na pohlavný vývin podľa Tannera. U anorektičiek s charakteristickým hypoestrogénnym stavom je interpretácia ešte zložitejšia, preto Soyka et al odporúčajú opierať sa o kostný vek [5]. Limitáciou našej práce je nehodnotenie špecifických kostných markerov podľa kostného veku.
Výsledky našej štúdie s analýzou nutričných, endokrinných, biochemických a denzitometrických ukazovateľov vo veľkej kohorte anorektičiek dopĺňajú patofyziologický obraz o jedinečnom osteopatickom stave pri mentálnej anorexii v adolescencii.
Záver
Porucha kostného metabolizmu je častou komplikáciou mentálnej anorexie u adolescentných dievčat. Závažná nutričná karencia spôsobuje dysreguláciu neuroendokrinných dráh a poruchu rovnováhy medzi osteoformačnými a osteoresorpčnými procesmi. Znížená osteoformačná aktivita so suboptimálnym maximom kostnej hmoty a zníženou denzitou kostného minerálu môžu viesť k rozvoju osteoporózy a zvýšenému riziku netraumatických fraktúr vo včasnej dospelosti.
Práca bola podporená grantom VEGA V-17–016–00 a MZ SR 2018/36-LFUK-10.
MUDr. Alžbeta Čagalová | alzbeta.cagalova@nudch.eu | www.fmed.uniba.sk | www.nudch.eu
Received | Doručeno do redakce | Doručené do redakcie 18. 2. 2020
Accepted | Přijato po recenzi | Prijaté po recenzii 25. 6. 2020
Received | Doručené do redakcie | Doručeno do redakce 18. 2. 2020
Accepted | Prijaté po recenzii | Přijato po recenzi 25. 6. 2020
Zdroje
Tichá Ľ, Payer J, Killinger Z et al. Porucha kostného metabolizmu pri mentálnej anorexii. [Impaired bone metabolism in anorexia nervosa]. Čes-Slov Pediat 2016; 71(5–6): 287–292.
Tichá Ľ, Hornová J, Birčák J. Mentálna anorexia a jej dôsledky v pediatrickej praxi. Pediatr Prax 2009; 10(2): 81–83.
American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. American Psychiatric Association Publishing: Washington, DC. 2013. ISBN 978-0-89042-555-8.
Tichá Ľ, Payer J, Killinger Z et al. Liečebné stratégie na optimalizáciu kostného metabolizmu pri mentálnej anorexii. Čes-Slov Pediat 2017; 72(4): 223–227.
Soyka LA, Grinspoon S, Levitsky LL et al. The Effects of Anorexia Nervosa on Bone Metabolism in Female Adolescents. J Clin Endocrinol Metab 1999; 84(12): 4489–4496. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem.84.12.6207>.
Ševčíková Ľ, Hamade J, Nováková J et al. Rast a vývojové trendy slovenských detí a mládeže za posledných 10 rokov. In: Ághová L. Životné podmienky a zdravie. Úrad verejného zdravotníctva SR: Bratislava 2004: 192–207. ISBN 80–7159–146–7.
Baim S, Leonard MB, Bianchi ML et al. Position Statement Official Positions of the International Society for Clinical Densitometry and Executive Summary of the 2007 ISCD Pediatric Position Development Conference. J Clin Desitom 2008; 11(1): 75–91. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jocd.2007.12.007>.
Misra M, Aggarwal A, Miller K et al. Effects of Anorexia Nervosa on Clinical, Hematologic, Biochemical, and Bone Density Parameters in Community-Dwelling Adolescent Girls. Pediatrics 2004; 114(6): 1574–1583. Dostupné z DOI: <http://dx.doi.org/10.1542/peds.2004–0540>.
Mehler PS, Andersen AE. Eating Disorders: A Guide to Medical Care and Complications. 2nd ed. Johns Hopkins University Press: Baltimore 2010: 144–155. ISBN 10: 0801893690 .
Lindsey RC, Mohan S. Skeletal effects of growth hormone and insulin-like growth factor-I therapy. Mol Cell Endocrinol 2016; 432: 44–55. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mce.2015.09.017>.
Soyka LA, Misra M, Frenchman A et al. Abnormal Bone Mineral Accrual in Adolescent Girls with Anorexia Nervosa. J Clin Endocrinol Metab 2002; 87(9): 4177–4185. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2001–011889>.
Misra M, Klibanski A. Bone metabolism in adolescents with anorexia nervosa. J Endocrinol Invest 2011; 34(4): 324–332. Dostupné z DOI: <http://dx.doi.org/10.1007/BF03347094>.
Mora S, Pitukcheewanont P, Kaufman FR et al. Biochemical markers of bone turnover and the volume and the density of bone in children at different stages of sexual development. J Bone Miner Res 1990; 14(10): 1664–1671. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.1999.14.10.1664>.
Misra M, Miller K, Almazan C et al. Alterations in Cortisol Secretory Dynamics in Adolescent Girls with Anorexia Nervosa and Effects on Bone Metabolism. J Clin Endocrinol Metab 2004; 89(10); 4972–4980. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2004–0723>.
Holick MF, Binkley NC, Bischoff-Ferrari HA et al. Evaluation, Treatment, and Prevention of Vitamin D Deficiency: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2011; 96(7): 1911–1930. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–0385>.
Abrams SA, Silber TJ, Esteban NV et al. Mineral balance and bone turnover in adolescents with anorexia nervosa. J Pediatr 1993; 123(2): 326–331. Dostupné z DOI: <http://dx.doi.org/10.1016/s0022–3476(05)81714–7>.
Audí L, Vargas DM, Gussinyé M et al. Clinical and biochemical determinants of bone metabolism and bone mass in adolescent female patients with anorexia nervosa. Pediatr Res 2002; 51(4): 497–504. Dostupné z DOI: <http://dx.doi.org/10.1203/00006450–200204000–00016>.
Salisbury JJ, Mitchell JE. Bone mineral density and anorexia nervosa in women. Am J Psychiatry 1991; 148(6): 768–774. Dostupné z DOI: <http://dx.doi.org/10.1176/ajp.148.6.768>.
Payer J, Dimová N, Killinger Z et al. Kostná denzita u pacientok s mentálnou anorexiou. Čes slov Psychiatr 1997; 93: 189–192.
Castro J, Lázaro L, Pons F et al. Predictors of Bone Mineral Density Reduction in Adolescents With Anorexia Nervosa. J Am Acad Child Adolesc Psychiatry 2000; 39(11): 1365–1370. Dostupné z DOI: <http://dx.doi.org/10.1097/00004583–200011000–00010>
Blumsohn A, Hannon R, Erate R et al. Biochemical markers of bone turnover in girls during puberty. Clin Endocrinol 1994; 40(5); 663–670. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.1994.tb03019.x>.
Štítky
Biochemie Dětská gynekologie Dětská radiologie Dětská revmatologie Endokrinologie Gynekologie a porodnictví Interní lékařství Ortopedie Praktické lékařství pro dospělé Radiodiagnostika Rehabilitační a fyzikální medicína Revmatologie Traumatologie OsteologieČlánek vyšel v časopise
Clinical Osteology

2020 Číslo 1
Nejčtenější v tomto čísle
- Netypické případy sekundární hyperparatyreózy při onemocnění a selhání ledvin: kazuistiky
- Doporučení pro pacienty s osteoporózou v době pandemie COVID-19
- Vplyv mentálnej anorexie na kostný metabolizmus
- Manažment osteoporózy a porúch metabolizmu vápnika v čase pandémie ochorenia COVID-19
