Změny kostní denzity a riziko osteoporotických fraktur u pacientů s psoriatickou artritidou
Bone mineral density and risk of osteoporotic fracture in patients with psoriatic arthritis
Psoriatic arthritis (PsA) is a chronic inflammatory musculoskeletal disease that affects especially peripheral and axial joints. PsA is a heterogeneous disease frequently associated with psoriasis and several other comorbidities, including osteoporosis. Osteoporosis (OP) is a chronic systemic skeletal disease characterized by progressive bone loss, disruption of bone microarchitecture, and increased risk of fragility fracture. Psoriatic arthritis and psoriasis are associated with reduced BMD and are at greater risk of developing osteoporosis and osteoporotic fracture which could be the reason of worsening of the prognosis in patients with psoriatic arthritis.
Keywords:
Psoriatic arthritis – densitometry – osteoporosis – bone mineral density – osteoporotic fractures
Autoři:
Studýnková Tomasová Jana
Působiště autorů:
Revmatologická klinika 1. LF UK a Revmatologický ústav, Praha
Vyšlo v časopise:
Clinical Osteology 2022; 27(1): 17-25
Kategorie:
Přehledové články
Souhrn
Psoriatická artritida (PsA) je chronické zánětlivé onemocnění asociované s psoriázou, které postihuje muskuloskeletální systém, zejména periferní i axiální klouby. Je to onemocnění velmi heterogenní, provázené řadou komorbidit. Osteoporóza (OP) je systémové onemocnění skeletu charakterizované progredujícím úbytkem kostní hmoty, porušením mikroarchitektury kostní tkáně a následným zvýšením její fragility a sklonem ke vzniku fraktur, a to i při nízké zátěži. Onemocnění OP má multifaktoriální etiologii. Psoriatická artritida a psoriáza jsou dle dostupných zdrojů spojeny se sníženou denzitou kostního minerálu (BMD – Bone Mineral Density) a zvýšeným rizikem zlomenin. Nízká BMD a osteoporóza jsou jedním z problémů, který má za následek nepříznivý vývoj a zhoršení prognózy u pacientů s psoriatickou artritidou.
Klíčová slova:
osteoporóza – psoriatická artritida – denzitometrie – denzita kostního minerálu – osteoporotické fraktury
Úvod
Psoriatická artritida (PsA) je chronické zánětlivé onemocnění patřící do skupiny spondyloartritid (SpA). Je to onemocnění velmi heterogenní, postihuje především muskuloskeletální soustavu. Zasaženy jsou hlavně periferní a axiální klouby, ale zánětlivé změny se mohou projevit, stejně jako u ostatních SpA, i na entezích (entezitida), nebo difuzním otokem celého prstu (daktylitida). Při axiálním postižení se dle oblasti jedná o sakroiliitidu, nebo spondylitidu [1]. Průběh PsA může být velmi variabilní a onemocnění je provázeno odlišnými klinickými, laboratorními i rentgenovým nálezy [2].
Psoriatická artritida je také provázena četnými komorbiditami včetně úbytku kostní hmoty – osteoporózy [3], tab. 1.
![Srovnání incidence komorbidit u pacientů s PsA vs kontroly. Upraveno podle [3]](https://www.clinicalosteology.org/media/cache/resolve/media_object_image_small/media/image_pdf/f3a7211b40fedc23f9380829a6fbd062.jpg)
Úbytek kostní hmoty u pacientů s revmatickými chorobami se projevuje jednak jako lokální úbytek kostní hmoty, ale může dojít také k systémové ztrátě. Patofyziologie úbytku kostní hmoty je komplexní. Projevy PsA na kostech zahrnují fokální resorpci (kloubní eroze a juxtaartikulární osteopenie), a dále kostní novotvorbu (ankylóza, periostitis a syndesmofyty) [1,4]. Vztah zánětlivého postižení u PsA ke kostní tkáni a celkové kostní hmotě není dosud zcela objasněný.
Osteoporóza (OP) je onemocnění s multifaktoriální etiologií. V roce 1993 byla definována jako systémové onemocnění skeletu, charakterizované úbytkem kostní hmoty, porušením mikroarchitektury kostní tkáně a následným zvýšením fragility kosti, se sklonem ke zlomeninám i při nízké zátěži, tzv. nízkozátěžovým zlomeninám, tj. zlomeninám způsobeným minimálním nebo nízkým traumatem, jako je pád z výšky stojící osoby nebo menší [5]. Vertebrální i nonvertebrální fraktury jsou tak velmi závažnými komplikacemi osteoporózy.
Celosvětově představuje OP významný zdravotní a sociální problém. Epidemiologické studie provedené v posledních letech ukazují neustálý vzestupný trend ve výskytu OP a zejména jejích komplikací – fraktur.
Pro diagnostické i terapeutické účely se ke hodnocení osteoporózy u dospělých využívá měření obsahu kostního minerálu (BMC – Bone Mineral Content) nebo denzity kostního minerálu (BMD – Bone Mineral Density).
Ke stanovení hodnoty BMD, která reprezentuje anorganickou část kostní hmoty, se používá několik technik, z nichž 4 jsou v současnosti běžně dostupné [5,6]. Jedná se o jednofotonovou absorpciometrii (SPA – Single Photon Absorptiometry); duální fotonovou absorpciometrii (DPA – Dual Photon Absorptiometry); dvouenergiovou rentgenovou absorpciometrii neboli DXA (Dualemission X-ray Absorptiometry) a kvantitativní výpočetní tomografii (QCT – Quantitative Computed Tomography).
Denzitometrie představuje nejmodernější, nejvíce využívanou a široce přijímanou techniku.
Z dostupných denzitometrických technik je v současné době v praxi preferována dvouenergiová RTG-absorpciometrie – DXA, která stanoví denzitu kostního minerálu projikovanou na jednotku plochy. Stanovená hodnota BMD je primárně vyjadřována v absolutních hodnotách (g/cm2). Termín denzita kostního minerálu (BMD), stanovená absorpciometrickými technikami, proto nepředstavuje objemovou hustotu, ale hustotu vztaženou na plochu, protože sken je dvourozměrný.
Rizikovými faktory snížení BMD a osteoporózy u zánětlivých revmatických chorob jsou obecné rizikové faktory osteoporózy. Přímý vliv na vznik osteoporózy má aktivita zánětlivého procesu cytokiny – interleukiny (IL: IL6, IL11, IL17 a IL23), tumor nekrotizující faktor alfa (TNFα), receptor-aktivátor jaderného faktoru kappa B (RANK) a jeho ligandu (RANKL), lokální regulační faktory (osteoprotegerin – OPG), změny v hladinách cirkulujících hormonů, metabolizmus kalcia, délka trvání zánětlivé nemoci, funkční defigurace vlivem revmatického onemocnění a také vliv podávaných léků.
Charakteristickými znaky PsA jsou i abnormální kalcifikace páteřních vazů a také novotvorba kosti na páteři a periferních kloubech. Pacienti s PsA mohou být postiženi zároveň i osteoartrózou anebo difuzní idiopatickou skeletální hyperostózu (DISH), tedy také stavy spojenými s tvorbou nové kosti.
Všechny tyto procesy mohou způsobit arteficiální zvýšení BMD měřeno pomocí DXA i přes přítomnost systémové osteoporózy a horší kvality kostí. BMD nemusí být tedy u pacientů s PsA dostatečně citlivým markerem pro diagnostiku osteoporózy. Souvislost mezi celkovým poklesem BMD a onemocněním psoriatickou artritidou není zatím dostatečně prozkoumána, byť četné studie tuto souvislost jasně naznačují [6].
Vzhledem k tomu, že změny denzity kostního minerálu, osteoporóza a risk vzniku osteoporotických fraktur u PsA jsou částečně podmíněny aktivitou tohoto onemocnění, potlačení zánětu pak vede ve svém důsledku ke zlepšení BMD a kvality kosti, jak prokazuje např. studie Simona z roku 2019 [7], ve které byla srovnávána skupina pacientů léčených pomocí DMARDs (Disease- Modifying Antirheumatic Drugs – chorobu modifikující antirevmatické léky) s kontrolní skupinou bez specifické léčby; pacienti s DMARDs vykazovali vyšší celkovou BMD.
Mechanizmus úbytku kostní hmoty u psoriatické artritidy
Snížení denzity u kostního minerálu pacientů s PsA představuje klinicky významný a rozšířený problém a je stále zdrojem četných lékařských kontroverzí. Celkový vliv zánětlivých mechanizmů u PsA na denzitu kostního minerálu není dosud dobře popsán. Existuje jen málo studií týkajících se manifestace snížení BMD, celkové osteoporózy a nízkozátěžových fraktur u psoriatické artritidy [6,8–10].
Zatímco lokalizovaný a systémový úbytek kostní hmoty v důsledku zvýšené aktivity osteoklastů u PsA byl již v minulosti dobře popsán na zvířecích modelech a translačních studiích, mechanizmy odpovědné za patologickou kostní remodelaci u PsA zůstávají dosud ne zcela objasněné, ačkoli byly identifikovány četné kandidátní molekuly a patofyziologické dráhy [8]. Kosterní soustava je tvořena z 80 % kostí kortikální a z 20 % kostí trabekulární. Trabekulární kost má, vzhledem ke své struktuře, však podstatně větší povrch než kost kortikální a její metabolický obrat je v důsledku větší povrchové plochy osmkrát vyšší než u kortikální kosti.
Obratle jsou tvořeny převážně trabekulární kostí, stejně jako trochanterická oblast stehenní kosti, zatímco krček femuru obsahuje převážně kortikální kost. Změny BMD lze zachytit dříve v trabekulární kosti ve srovnání s kostí kortikální.
O nízkozátěžových (osteoporotických) frakturách a nízkých hodnotách BMD u pacientů PsA není však dosud dostatek údajů. Některé studie prokázaly u pacientů s delším trváním onemocnění PsA normální hodnoty BMD, přesto ale u nich byla zvýšená frekvence nízkozátěžových fraktur [6].
Dvě starší studie popisují zvýšenou prevalenci osteoporózy a snížené kostní denzity (osteopenie) u pacientů s psoriázou [8,11].
Izraelská studie případů a kontrol Dreihera, sledující 7 936 pacientů s psoriázou a 14 835 kontrolních subjektů, prokázala pro pohlaví specifickou asociaci OP a psoriázy. Prevalence osteoporózy byla významně vyšší ve srovnání s kontrolní skupinou u mužů s psoriázou (3,1 vs 1,7 %; p < 0,001; OR = 1,86; 95% CI 1,44–2,39), ale toto významné zvýšení nebylo prokázáno u žen s PsA (22,3 vs 20,2 %; p = 0,008; OR = 1,13; 95% CI 1,03–1,25) [11].
Keller et al naznačili ve velké kohortové studii (17 507 případů osteoporózy a 52 521 kontrol) na Tchaj-wanu, že u pacientů s osteoporózou byla signifikantně vyšší prevalence dříve diagnostikované psoriázy [9].
Zatím bylo provedeno jen několik kontrolovaných studií, které se zabývaly změnami v kostní mikroarchitektuře a s tím spojeným zhoršením kvality kostí u psoriatické artritidy. Dosud tak neexistují žádné přesvědčivé důkazy, které by potvrzovaly zhoršenou kvalitu kostí u pacientů s PsA.
Kocijan et al hodnotili pomocí metody periferní kvantitativní výpočetní tomografie s vysokým rozlišením (HR-pQCT) na skupinách 50 pacientů s PsA, 30 pacientů s psoriázou a 70 zdravých kontrolních subjektech objem trabekulární kosti, nehomogenitu trabekulární kosti a kortikální tloušťku a BMD v oblasti distálního radia. Zjistili, že minerální denzita trabekulární kosti byla u PsA v porovnání se zdravými kontrolami významně snížena, zatímco u pacientů s psoriázou, tj. bez přítomnosti artritidy, nebyl pozorován žádný významný rozdíl [12].
U pacientů s revmatoidní artritidou (RA) je již známo, že dochází jak k lokální ztrátě kostní hmoty, projevující se fokálními erozemi a zúžením kloubního prostoru, tak k systémovému úbytku kosti a snížení celkové minerální denzity kostí v páteři a kyčli [13].
V souborné práci Chandranové et al, zahrnující přehled studií zaměřených na hodnocení kostní hmoty a sledování nízkozátěžových fraktur u PsA, autoři zmiňují, že 13 z 21 publikovaných prací prokázalo zvýšenou ztrátu kostní hmoty v porovnání se zdravými kontrolami [14], zbývající studie tento úbytek kostní hmoty neprokázaly. Denzita kostního minerálu v těchto pracích byla, s výjimkou dvou měřených pomocí kvantitativního USG a HR-pQCT, hodnocena pomocí metody denzitometrie.
U psoriatické artritidy je dobře popsána lokální ztráta kostní hmoty, která je klíčovým rysem poškození kosti u PsA. Některé studie ale rovněž odhalily, stejně jako u RA, nižší i celkovou denzitu kostního minerálu, a tedy vyšší riziko zlomenin kostí u pacientů s psoriázou a psoriatickou artritidou ve srovnání se zdravými kontrolami [14,15], tab. 2.
Upraveno podle [15]
![Incidence osteoporózy u psoriatické artritidy, psoriázy a revmatoidní artritidy vs zdravé kontroly.<br>
Upraveno podle [15]](https://www.clinicalosteology.org/media/cache/resolve/media_object_image_small/media/image_pdf/669d0c8bd9d10c0d58c2d60eb69584ba.jpg)
CI – interval spolehlivosti/Confidence Interval HR – poměr rizik/Hazard ratio
Reddy mezi lety 2001 až 2008 porovnal 2 481 pacientů s PsA a 17 107 pacientů s RA. Sledovali hodnoty T-skóre měřené na bederní páteři (-0,54 vs -0,36; p = 0,077) a krčku stehenní kosti (-0,88 vs -0,93; p = 0,643), u pacientů s RA byly tyto významně nižší než u pacientů s PsA. Avšak pacienti s PsA měli v průměru vyšší index tělesné hmotnosti (BMI) než pacienti s RA a zdravé kontroly, pokud byl tento faktor zohledněn, hustota kostí u PsA byla snížena podobně jako u pacientů s RA [16].
V norské studii HUNT sledující osteoporotické fraktury v nemocnicích z okresu Nord-Trondelag mezi lety 1995–2013 (48 194 osob s 2 804 případy psoriázy), nebyla pozorována žádná souvislost mezi psoriázou, její závažností a rizikem zlomenin předloktí/kyčle nebo mezi psoriázou a osteoporózou, či nízkými hodnotami BMD [17].
Ve studii na skupině 18 pacientů s neaxiální psoriatickou artritidou a 100 zdravých kontrol Frediani et al [18] prokázali, že BMD byla významně nižší u pacientů s artritidou ve srovnání se zdravými pacienty, a to bez ohledu na pohlaví, věk a menopauzální stav. Jejich studie ukázala, že snížení BMD bylo pozorováno u více než dvou třetin pacientů s psoriatickou artritidou a nekorelovalo s aktivitou zánětlivého onemocnění ani s délkou jeho trvání. Byla ale nalezena korelace s věkem a počtem let po menopauze.
Nolla et al ve své studii sledovali 52 pacientů s periferní psoriatickou artritidou [19]. Postmenopauzální pacientky s PsA měly významně nižší BMD měřené v krčku stehenní kosti v porovnání se zdravými kontrolami. Avšak to se významně nelišilo u mužů a premenopauzálních žen. V této studii nebyl popsán v porovnání s kontrolní skupinou významný rozdíl v BMD bederní páteře v žádné ze sledovaných podskupin – muži, premenopauzální a postmenopauzální ženy s PsA [19].
Rizikové faktory snížení kostní denzity u psoriatické artritidy
V několika různých studiích [14] byly u pacientů s psoriatickou artritidou sledovány rizikové faktory nižší BMD, jako doba trvání onemocnění, počet zánětlivě postižených kloubů, přítomnost erozí, přítomnost entezitidy, daktylitida a skóre PASI (The Psoriasis Area and Severity Index) [8,20–22]. Nejčastějším rizikovým faktorem nízké kostní denzity v těchto studiích byla uváděna délka trvání onemocnění PsA, ale zcela jasná asociace mezi nízkou BMD a celkovou délkou trvání nemoci PsA nebyla prokázána. Průměrná doba trvání onemocnění PsA u jednotlivých studií se lišila a pohybovala se mezi 2,25 až 13,65 lety [14]. Bormanová [22] udává, že u pacientů s psoriatickou artritidou, v porovnání s pacienty, kteří trpěli pouze kožní formou psoriázy, narůstá riziko osteoporózy a s ní spojené riziko nízkozátěžových fraktur s délkou přítomnosti artritidy.
Vztah k aktivitě onemocnění nebyl opět jednoznačně prokázán, pouze Riescova práce ukazuje u pacientů signifikantní asociaci s nižší BMD měřenou v bederní páteři a s vyššími průměrnými hodnotami sedimentace [23].
Čtyři ze studií zahrnutých v přehledovém článku Chadranové se zabývaly asociací skóre závažnosti psoriázy PASI a hodnotou BMD. V práci Pedreiry [10] byla průměrná hodnota PASI 2,2; naopak Attiaová uvádí nejvyšší průměrné PASI skóre 20,8 [24]. Nicméně jasná spojitost s tíží psoriázy hodnocenou skórem PASI a nižší hodnotou BMD nebyla jednoznačně prokázána.
V Graziově práci [21] sledovali entezitidy (u 78,1 %) a daktylitidy (45,2 %), ale ty rovněž nebyly asociovány s nižší BMD (obr. 1).
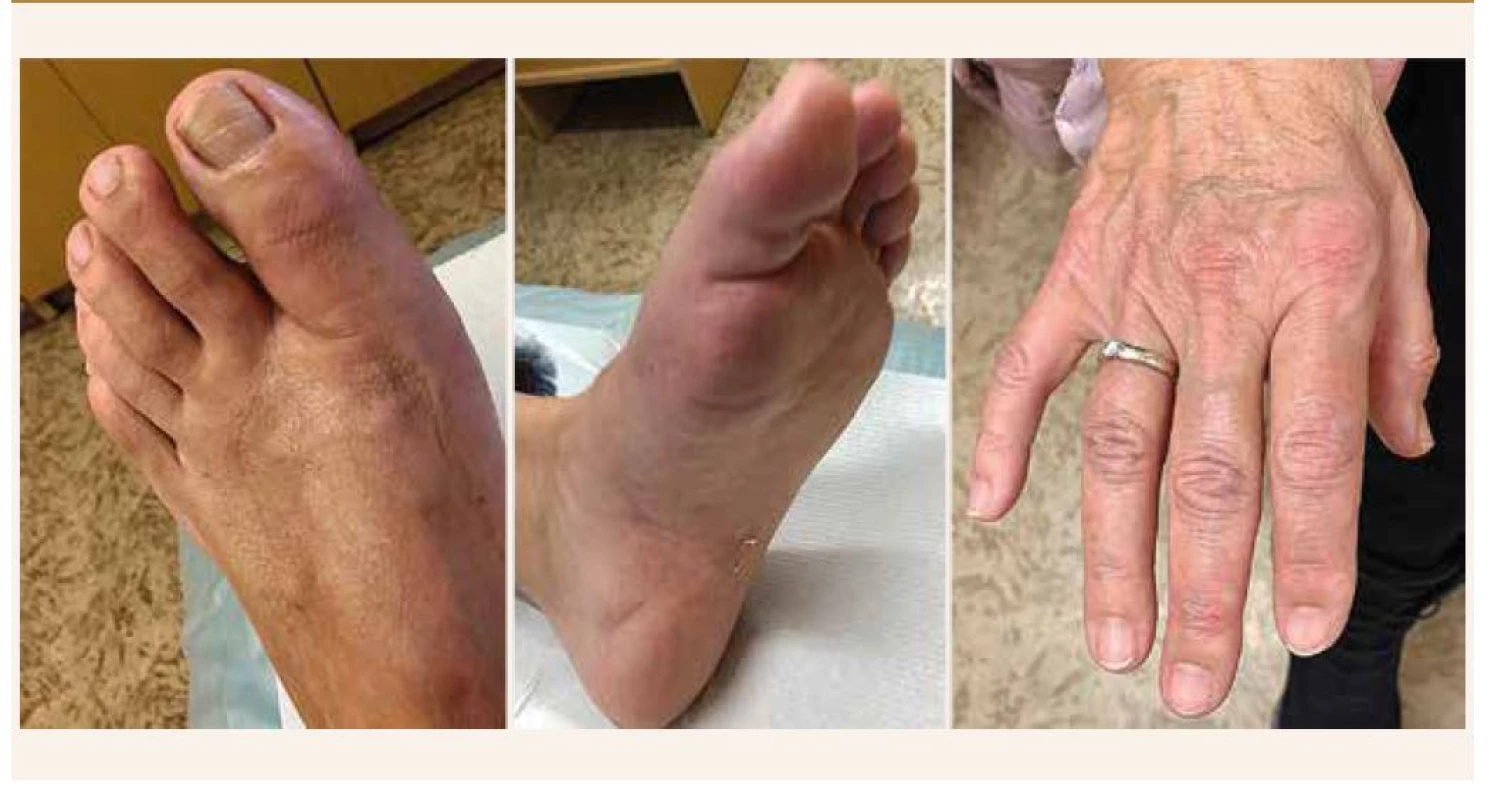
Rizikem spojeným se systémovým užíváním glukokortikoidů u pacientů s psoriatickou artritidou se zabývalo 7 studií [14]. Pouze Grazio však reportoval vyšší celkovou kumulativní dávku glukokortikoidů: 39,1 % pacientů s PsA užívalo kortikosteroidy a průměrná kumulativní dávka byla u mužů 59,4 (SD 45,9) mg/rok, zatímco u žen 41,8 mg/rok [24,6] a tato korelovala s nižním BMD měřeném na bederní páteři [21].
Ve velké observační studii z roku 2020 Xia poukazuje na možnou souvislost poklesu celkové BMD a vzniku OP a užívání DMARDs – metotrexátu a cykloporinu A u pacientů s PsA [25].
Žádná ze studií neprokázala asociaci mezi užíváním biologických preparátů a hodnotami BMD [14].
V již výše zmíněné studii Simona [7] porovnávali pacienty léčené DMARDs (metotrexátem nebo biologickými DMARDs) se skupinou bez DMARds. Pacienti s DMARDs měli vyšší celkovou objemovou (volumetric) BMD/vBMD (312 ± 5 3 vs 290 ± 5 4; p = 0,004) a trabekulární vBMD (171 ± 38 vs 156 ± 39; p = 0,010) ve srovnání s kontrolami bez DMARDr. Také vykazovali lepší kostní mikroarchitekturu a vyšší počet trabekul (2,09 ± 0,33 vs 1,99 ± 0,35; p = 0,047) [7].
Psoriatická artritida a riziko osteoporotických fraktur
Velká kohortová studie Ogdiehové z roku 2017 zahrnující 9 788 pacientů s psoriatickou artritidou prokázala v porovnání s běžnou populací zvýšené riziko zlomenin u pacientů s psoriázou a psoriatickou artritidou [15].
V 5 jiných studiích se osteoporotické zlomeniny vyskytly s různou prevalencí pohybující se v rozmezí od 12 % do 40 % [8,23,26–28]. V práci van Weijdenové [28], která sledovala 113 mladých nemocných (průměrný věk 37 let) se spondylartritidou, byla u pacientů s psoriatickou artritidou zjištěna vysoká prevalence (40 %) zlomenin obratlů, a ta byla také spojena s nižší hodnotou BMD, avšak tento výsledek může být ovlivněn malým podílem nemocných s PsA (10 pacientů) z celkového počtu sledovaných.
Ve studii postmenopauzálních žen trpících PsA (Riesco et al) byla odhadovaná prevalence osteoporotických fraktur 14,3 % u psoriatických pacientek (95% CI 7,11; 21,49 %), oproti 4,4 % (95% CI 0,19, 8,61 %; p = 0,013) u zdravých kontrol [23]. Také v práce Busquetsové se většina popisovaných zlomenin (16 z 19) vyskytla u postmenopauzálních žen [26], ale nebyl zde popsán žádný rozdíl v BMD bederní páteře mezi pacienty s PsA a obecnou španělskou populací. Problém této studie opět může být nízký počet (19 pacientů) sledovaných subjektů.
V již ve výše zmíněné norské studii HUNT se vyšší prevalence osteoporotických fraktur u pacientů s PsA v porovnání s běžnou populací neprokázala [17].
Také ve studii Lo Giudice z roku 2020, ve které bylo sledováno 92 pacientů s PsA a 184 kontrol, nebyla mezi oběma skupinami prokázána větší incidence OP fraktur: 1 020/100 000 (95% CI 510–1 930) vs 870; (95% CI 520–1 390; p = 0,36). U pacientů s PsA byly ale častější vertebrální zlomeniny než u kontrol: incidence na 1 020/100 000 (95% CI 510–1 930) vs 460 (95% CI 240–920), ale incidence nedosáhla statistické významnosti (p = 0,06) [29].
Je zajímavé, že se patologické fraktury prokázaly u pacientů ve sledovaných skupinách bez závislosti na hodnotě (snížení) BMD, a to jak u nemocných s PsA, tak u zdravých kontrol [8,23]. Zdá se tedy, že riziko patologické fraktury nemusí být nutně spojeno s nižším BMD a vyšším rizikem osteoporózy [6].
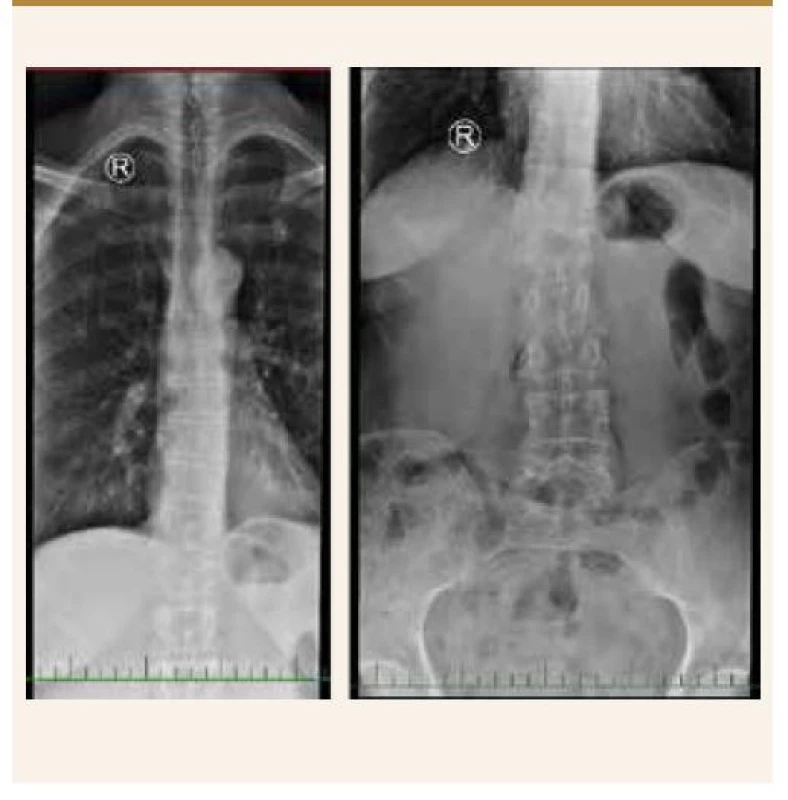
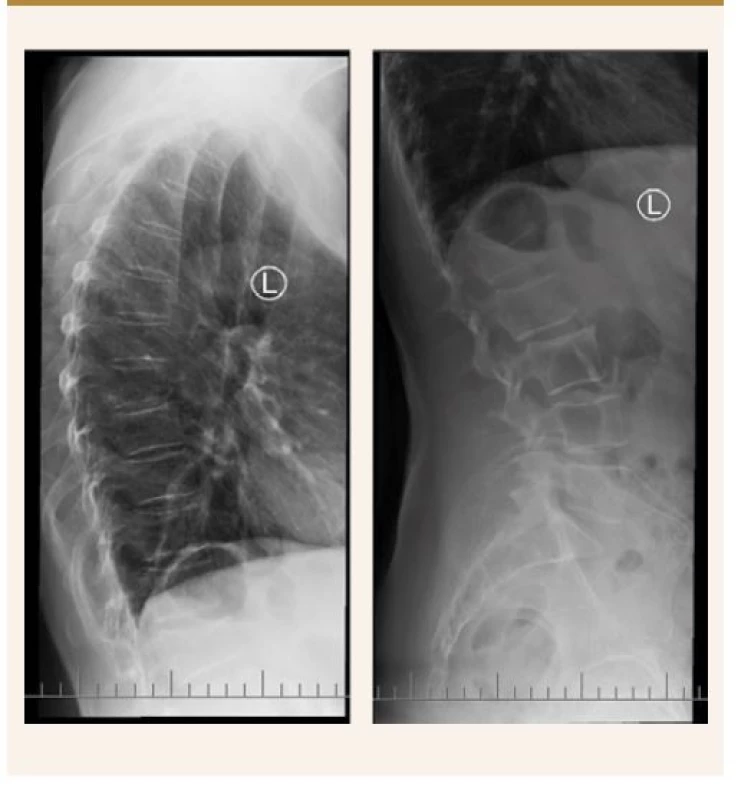
Kathuria s kolegy provedli ve Spojených státech velmi rozsáhlou průřezovou studii zahrnující 183 725 pacientů s psoriázou a 28 765 pacientů s psoriatickou artritidou. Zjistili, že pacienti s psoriázou/psoriatickou artritidou měli výrazně vyšší pravděpodobnost diagnózy nízké kostní hustoty, osteoporózy a patologických fraktur v porovnání s běžnou populací [30], obr. 2, obr. 3.
Markery kostní remodelace
Kostní hmota je vytvářena soustavnou dynamickou interakcí mezi buňkami tvořící kostní matrix – osteoblasty (OB), které se po zabudování dovnitř do kostní tkáně nazývají osteocyty, a buňkami resorbujícími kost – osteoklasty (OC) [5]. Pro udržení kostní homeostázy je nutná komplexní koordinace činnosti osteoblastů a osteoklastů. Na tomto procesu se podílí mnoho molekulárních faktorů regulujících buněčnou diferenciaci, zrání a funkci, a to prostřednictvím aktivace receptorů a jejich příslušných ligandů.
Proces udržení kostní homeostázy je regulován řadou systémových hormonů – parathormon, androgeny, estrogeny, IGF1 (Insulin like Growth Factor 1, kortizol atd), a lokálních regulačních faktorů (osteoprotegerin – OPG, sklerostin), ale podílejí se na něm i jiné faktory a mediátory. Některé z těchto mediátorů byly původně považovány za složky pouze imunitního systému – interleukiny (IL6, IL11, IL17 a IL23), tumor nekrotizující faktor alfa (TNFα), receptor-aktivátor jaderného faktoru kappa B (RANK) a jeho ligandu (RANKL), ale zároveň se ukazují být nyní rozhodujícími faktory i v biologii osteoklastů a osteoblastů [31].
V případě zánětlivého procesu jsou tyto koordinované aktivity osteoblastů a osteoklastů narušeny, což vede k remodelaci kosti, a to má za následek strukturální deformity [5,6].
V běžné praxi se jako marker kostní novotvorby používá PINP (N-terminální propeptid prokolagenu typu 1) a jako ukazatel osteoresorpce pak CTX-I (C-terminální příčně vázaný telopeptid kolagenu typu 1).
Markery kostního obratu – alkalická fosfatáza (ALP), C-terminální telopeptid kolagenu I (CTX), TNFα-related Apoptosis-Inducing Ligand (TRAIL) a osteoprotegerin byly korelovány s BMD ve čtyřech studiích [20,31–33] s PsA. Vztah mezi těmito markery a BMD nebyl v těchto studiích konzistentní. Studie Bormanové [22] prokázala, že sérové hodnoty kalcia, fosforu, alkalické fosfatázy a marker kostního obratu CTX v séru se u pacientů s nebo bez přítomné PsA významně neliší.
Sérovým hladinám TRAIL a OPG a jejich vztahu k BMD u pacientů s PsA se věnoval Hofbauer [20]. V jeho studii u jedné třetiny pacientů s PsA, převážně mužů, byly nižší hodnoty BMD, ale nebyla zde významná korelace se žádným ze sledovaných markerů kostního metabolizmu. Grisar et al [33] prokázali zvýšenou resorpci kosti u všech typů sledovaných spondyloartritid, a také větší novotvorbu kostí se zvýšenou alkalickou fosfatázou; to nebylo spojeno s větší prevalencí nižší BMD u PsA. Attiaová et al ve své práci popisují zvýšené hladiny OPG u pacientů, jak s psoriázou, tak se psoriatickou artritidou, ale pouze pacienti s psoriatickou artritidou měli zároveň nižší hodnoty BMD [24].
Diskuse
Psoriatická artritida patří do skupiny zánětlivých revmatických onemocnění, u kterých jako jednu ze zásadních komorbidit nacházíme nízké hodnoty BMD a osteoporózu. Pacienti s nízkou BMD/OP jsou vystaveni vyššímu riziku vzniku nízkozátěžových zlomenin vyžadujících včasnou intervenci, aby se minimalizoval dopad zlomenin na kvalitu a délku jejich života [6].
Nízká BMD, osteoporóza a s nimi spojené vertebrální a nonvertebrální fraktury jsou závažným medicínským, sociálním i ekonomickým problémem. Pouze 20 % žen, které utrpěly frakturu krčku femuru, je schopno se kompletně navrátit do funkčně aktivního stavu a více než 40 % dále není schopno po fraktuře chůze bez dopomoci [11]. Fraktury, nejen femorální, ale i vertebrální, jsou také spojeny se signifikantně vyšší mortalitou.
V této přehledové práci jsem se pokusila shrnout současná dostupná data týkající se možného zvýšeného rizika snížené BMD a osteoporózy u pacientů s psoriatickou artritidou, zejména ve vztahu k aktivitě PsA, jejím projevům, a také ve vztahu k protizánětlivé a chorobu modifikující léčbě PsA. Tento přehled je doplněn obrazovou přílohou vycházející z vlastních klinických kazuistik.
Data z různých prací zabývajících se touto tematikou nejsou zatím zcela konzistentní. Vzájemné srovnání jednotlivých studií je často obtížné s ohledem na různé primární a sekundární cíle prací a také různou metodiku hodnocení [14].
Většina prací vycházela z hypotézy, že pacienti s psoriatickou artritidou, vzhledem k zánětlivému patofyziologickému mechanizmu choroby, jsou, stejně jako pacienti s jinými zánětlivými revmatickými chorobami – revmatoidní artritidou či jinou spondylartritidou, ve větší míře postiženi nízkou hodnotou BMD a osteoporózou. Některé práce poukazují na možnost většího výskytu snížení BMD u PsA v porovnání s ostatními zánětlivými kloubními chorobami. Avšak studie srovnávající pacienty s psoriatickou artritidou se zdravými kontrolami tento závěr spíše nepodporují a v obou populacích nenacházejí významný rozdíl v hodnotách BMD [23].
Diskuse o tom, zda jsou pacienti s psoriázou či psoriatickou artritidou rizikovější z hlediska snížené kostní denzity a osteoporózy, s následným vyšším rizikem vzniku osteoporotické fraktury, jsou stále aktuálnější a výzkum v této problematice nadále probíhá [14]. Důsledná léčba onemocnění psoritickou artritidou, pomocí DMARDs i biosimilárních DMARDs, vede ke snížení aktivity, a tedy k utlumení zánětlivého procesu, a to pak zřejmě vede ke zlepšení BMD i zlepšení kostní architektury u pacientů [7].
K vytvoření jasných doporučení, kdy a jakým způsobem by měla být celková kostní denzita u pacientů s PsA a psoriázou hodnocena, je třeba poskytnout klinickým lékařům jasné důkazy. Je proto nutné více porozumět vzájemnému vztahu zánětlivé choroby jakou jsou psoriáza a psoriatická artritida, a snížené kostní denzity/OP. Jedině takto může být pak zajištěna správná léčba vedoucí ke snížení rizika zlomenin, a to zejména u starších osob.
Závěr
Zde předložený přehled problematiky výskytu snížené denzity kostního minerálu, osteoporózy a nízkozátěžových fraktur u pacientů s psoriatickou artritidou a psoriázou naznačuje asociaci mezi těmito diagnostickými jednotkami. Z dosud dostupných zdrojů vyplývá, že snížení celkové BMD a osteoporóza jsou u pacientů s psoriatickou artritidou častými nálezy.
Nízká BMD a osteoporóza jsou také jedním z problémů, který má za následek nepříznivý vývoj a zhoršení prognózy u pacientů s psoriatickou artritidou.
Psoriatická artritida a psoriáza, podobně jako jiná zánětlivá revmatická onemocnění, jsou spojena se zvýšeným rizikem zlomenin. U pacientů s psoriázou a psoriatickou artritidou je proto třeba důsledně dbát na screening a následně léčbu osteoporózy v souladu se současnými doporučeními pro léčbu stavů nízké kostní denzity a osteoporózy.
Received | Doručené do redakcie | Doručeno do redakce 4. 2. 2022
Accepted | Prijaté po recenzii | Přijato po recenzi 26. 2. 2022
MUDr. Jana Tomasová Studýnková, PhD.
www.revma.cz
Zdroje
1. Taylor W, Gladman D, Helliwell P et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international s tudy. A rthritis R heumatol 2 006; 5 4(8): 2 665–2673. Dostupné z DOI: <http://dx.doi.org/10.1002/art.21972>.
2. Gladman DD, Antoni C, Mease P et al. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann Rheum Dis 2 005; 6 4(Suppl 2 ): i i14–17. Dostupné z DOI: < http://dx.doi. org/10.1136/ard.2004.032482>.
3. Kaine J, Song X, Kim G et al. Higher Incidence Rates of Comorbidities in Patients with Psoriatic Arthritis Compared with the General Population Using U.S. Administrative Claims Data. J Manag Care Spec Pharm 2019; 25(1): 122–132. Dostupné z DOI: <http://dx.doi.org/10.18553/jmcp.2018.17421>.
4. Chandran V, Raychaudhuri SP. Geoepidemiology and environmental factors of psoriasis and psoriatic arthritis. J Autoimmun 2 010; 3 4(3): J 314–J321. Dostupné z DOI: < http://dx.doi.org/ 10.1016/j.jaut.2009.12.001>.
5. Lorentzon M, Cummings SR. Osteoporosis: the evolution of a diagnosis. J Intern Med 2015; 277(6): 650–661. Dostupné z DOI: <http://dx.doi.org/10.1111/joim.12369>.
6. Chen TL, Lu JW, Huang YW et al. Bone Mineral Density, Osteoporosis, and Fracture Risk in Adult Patients with Psoriasis or Psoriatic Arthritis: A Systematic Review and Meta-Analysis of Observational Studies. J Clin Med 2020; 9(11): 3712. Dostupné z DOI: <http://dx.doi.org/10.3390/jcm9113712>.
7. Simon D, Kleyer A, Bayat S et al. Effect of disease-modifying anti-rheumatic drugs on bone structure and strength in psoriatic arthritis patients. Arthritis Res Ther 2019 3; 21(1): 162. Dostupné z DOI: <http://dx.doi.org/10.1186/s13075–019–1938–3>.
8. Paine A, Ritchlin Ch. Altered bone remodeling in psoriatic disease: New insights and future directions. Calcif Tissue Int 2018; 102(5): 559–574. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–017–0380–2>.
9. Keller J, Kang J, Lin H. Association between osteoporosis and psoriasis: results from the Longitudinal Health Insurance Database in Taiwan. Osteoporos Int 2013; 24(6): 1835–1841. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–012–2185–5>.
10. Pedreira PG, Pinheiro MM, Szejnfeld VL. Bone mineral density and body composition in postmenopausal women with psoriasis and psoriatic arthritis. Arthritis Res Ther 2011; 13(1): R16. Dostupné z DOI: <http://dx.doi.org/10.1186/ar3240>.
11. Dreiher J, Weitzman D, Cohen A. Psoriasis and osteoporosis: a sex-specific association? J Invest Dermatol. 2009; 129(7): 1643– 1649. Dostupné z DOI: <http://dx.doi.org/10.1038/jid.2008.432>.
12. Kocijan R, Englbrecht M, Haschka J et al. Quantitative and qualitative changes of bone in psoriasis and psoriatic arthritis patients. J Bone Miner Res 2015; 30(10): 1775–1783. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2521>.
13. Goldring SR. Differential mechanisms of de-regulated bone formation in rheumatoid arthritis and spondyloarthritis. Rheumatology ( Oxford) 2 016; 5 5(1): 5 6–60. Dostupné z DOI: < http://dx.doi. org/10.1093/rheumatology/kev283>.
14. Chandran S, Aldei A, Johnson SR et al. Prevalence and risk factors of low bone mineral density in psoriatic arthritis: A systematic review. Semin Arthritis Rheum 2016; 4 6(2): 174–182. Dostupné z DOI: <http://dx.doi.org/10.1016/j.semarthrit.2016.05.005>.
15. Ogdie A, Harter L, Shin D et al. The risk of fracture among patients with psoriatic arthritis and psoriasis: a population-based study. Ann Rheum Dis 2017; 76(5): 882–885. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2016–210441>.
16. Reddy SM, Anandarajah AP, Fisher MC et al. Comparative analysis of disease activity measures, use of biologic agents, body mass index, radiographic features, and bone density in psoriatic arthritis and rheumatoid arthritis patients followed in a large U.S. disease registry. J Rheumatol 2 010; 3 7(12): 2 566–2572. Dostupné z DOI: <http://dx.doi.org/10.3899/jrheum.100483>.
17. Modalsli EH, Asvold BO, Romundstad PR et al. Psoriasis, fracture risk and bone mineral density: the HUNT Study, Norway. Br J Dermatol 2017; 176(5): 1162–1169. Dostupné z DOI: <http://dx.doi.org/10.1111/bjd.15123>.
18. Frediani B, Allegri A, Falsetti et al. Bone mineral density in patients with psoriatic arthritis. J Reumatol 2001; 28(1): 138‐143.
19. Nolla JM, Fiter J, Rozadilla A et al: Bone mineral density in patients with peripheral psoriatic arthritis. Rev Rhum Engl 1999; 66(10): 457‐461.
20. Hofbauer LC, Schoppet M, Christ M et al.Tumour necrosis factor-related apoptosis-inducing ligand and osteoprotegerin serum levelsin psoriatic arthritis. Rheumatology (Oxford) 2006; 45(10): 1218–22. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kel108>.
21. Grazio S, Cvijetić S, Vlak T et al. Osteoporosis in psoriatic arthritis: is there any? Wien Klin Wochenschr 2011; 123(23–24): 743–750. Dostupné z DOI: <http://dx.doi.org/10.1007/s00508–011–0095–8>.
22. Borman P, Babaoğlu S, Gur G et al. Bone mineral density and bone turnover in patients with psoriatic arthritis. Clin Rheumatol 2008; 27(4): 4 43–447. Dostupné z DOI: <http://dx.doi.org/10.1007/s10067–007–0725–8>.
23. Riesco M, Manzano F, Font P et al. Osteoporosis in psoriatic arthritis: an assessment of densitometry and fragility fractures. Clin R heumatol 2 013; 3 2(12):1799–1804. Dostupné z DOI: < http:// dx.doi.org/10.1007/s10067–013–2322–3>.
24. Attia EA, Khafagy A, Abdel-Raheem S et al. Assessment of osteoporosis in psoriasis with and without arthritis: correlation with disease severity. Int J Dermatol 2011; 50(1): 30–35. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–4632.2010.04600.x>.
25. Xia J, Xie SY, Liu KQ et al. Systemic evaluation of the relationship between psoriasis, psoriatic arthritis and osteoporosis: observational and Mendelian randomisation study. Ann Rheum Dis 2020; 79(11): 1460–1467. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2020–217892>.
26. Busquets N, Vaquero CG, Moreno JR et al. Bone mineral density status and frequency of osteoporosis and clinical fractures in 155 patients with psoriatic arthritis followed in a university hospital. Reumatol Clin 2014; 10(2): 89–93. Dostupné z DOI: <http://dx.doi.org/10.1016/j.reuma.2013.07.006>.
27. Kocijan R, Finzel S, Englbrecht M et al. Differences in bone structure between rheumatoid arthritis and psoriatic arthritis patients relative to autoantibody positivity. Ann Rheum Dis 2014; 73(11): 2022–2028. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–203791>.
28. van der Weijden MA, van der Horst-Bruinsma IE, van Denderen JC et al. High frequency of vertebral fractures in early spondylarthropathies. Osteoporos Int 2012; 23(6): 1683–1690. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–011–1766-z>.
29. Lo Giudice LF, Scolnik M, Pierini FS et al. Fragility fractures in psoriatic arthritis patients: a matched retrospective cohort study. Clin Rheumatol 2020; 39(12): 3685–3691. Dostupné z DOI: <http://dx.doi.org/10.1007/s10067–020–05074–8>.
30. Kathuria P, Gordon KB, Silverberg JI. Association of psoriasis and psoriatic arthritis with osteoporosis and pathological fractures. J Am Acad Dermatol 2017; 76(6): 1045–1053. e3. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaad.2016.11.046>.
31. Boyce BF, Xing L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Arch Biochem Biophys 2008; 473(2): 139–146. Dostupné z DOI: <http://dx.doi.org/10.1016/j.abb.2008.03.018>.
32. D’Epiro S, Marocco C, Salvi M et al. Psoriasis and bone mineral density: implications for long-term patients. J Dermatol 2014; 41(9): 783–787. Dostupné z DOI: <http://dx.doi.org/10.1111/1346–8138.12546>.
33. Grisar J, Bernecker PM, Aringer M et al. Ankylosing spondylitis, psoriatic arthritis, and reactive arthritis show increased bone resorption, but differ with regard to bone formation. J Rheumatol 2002; 29(7): 1430–1436.
Štítky
Biochemie Dětská gynekologie Dětská radiologie Dětská revmatologie Endokrinologie Gynekologie a porodnictví Interní lékařství Ortopedie Praktické lékařství pro dospělé Radiodiagnostika Rehabilitační a fyzikální medicína Revmatologie Traumatologie OsteologieČlánek vyšel v časopise
Clinical Osteology

2022 Číslo 1
Nejčtenější v tomto čísle
- Chondroblastóm femuru – benígny nádor s potenciálne vážnymi následkami: kazuistika
- Casus socialis: sociálny či medicínsky problém? Kazuistika
- Změny kostní denzity a riziko osteoporotických fraktur u pacientů s psoriatickou artritidou
- A need for predictive and personalized approach in osteoporosis treatment: individual treatment plan
